Biohaven annuncia l'accettazione da parte della FDA e la revisione prioritaria della domanda di nuovo farmaco, il Troriluzolo, per il trattamento dell'atassia spinocerebellare
Biohaven ha annunciato che la Food and Drug Administration (FDA) statunitense ha accettato per la revisione la domanda di nuovo farmaco (NDA) della società biohaven per il troriluzolo per il trattamento di pazienti adulti con atassia spinocerebellare (SCA) e ha concesso la revisione prioritaria. Questa designazione viene assegnata alle domande per farmaci che offrirebbero un miglioramento significativo rispetto ad altri trattamenti disponibili per un dato disturbo o fornirebbero un’opzione di trattamento laddove non ne esiste nessuna. Nel caso della SCA, una rara malattia genetica neurodegenerativa, il troriluzolo sarebbe il primo e unico trattamento approvato dalla FDA per questo disturbo potenzialmente letale. La decisione della FDA in merito alla NDA è prevista entro 6 mesi dalla presentazione (durante il 3Q 2025). Sulla base delle tempistiche della revisione prioritaria della FDA e se alla fine approvata, biohaven è pronta a commercializzare il troriluzolo per la SCA negli Stati Uniti nel 2025.
Andrew Rosen, amministratore delegato della National Ataxia Foundation (NAF), ha dichiarato: “Il programma SCA di biohaven riflette anni di ricerca clinica dedicata e collaborazione con i principali esperti mondiali e gruppi di advocacy per far progredire il campo dell’atassia. Siamo orgogliosi che il nostro impegno pluriennale per finanziare e supportare il Clinical Research Consortium for the Study of Cerebellar Ataxia abbia svolto un ruolo così fondamentale nel fornire il braccio di controllo esterno dello studio di biohaven. L’obiettivo di CRC-SCA è migliorare la nostra comprensione della progressione della malattia SCA e promuovere lo sviluppo di terapie modificatrici della malattia per SCA”. Il signor Rosen ha aggiunto: “A nome dei pazienti e delle famiglie, che hanno visto generazioni di familiari soccombere a questa malattia devastante e hanno atteso per decenni un trattamento che potesse rallentare la progressione della malattia, ringrazio la FDA non solo per aver accettato questa NDA per la revisione, ma anche per aver riconosciuto la necessità di urgenza per la nostra comunità sotto forma di revisione prioritaria”.
Cos'è un NDA e cosa succede dopo?
L’approvazione di un nuovo medicinale per l’uso negli Stati Uniti comporta un processo dettagliato supervisionato dalla Food and Drug Administration (FDA) statunitense. Questo processo è chiamato New Drug Application (NDA). Le NDA sono fondamentali per garantire che i medicinali siano sicuri ed efficaci prima che siano disponibili al pubblico.
Melissa Beiner, MD, Responsabile dello sviluppo clinico presso SCARifugio biologico, ha commentato, “La nostra richiesta di NDA è il culmine di oltre 8 anni di ricerca clinica e rappresenta un’importante collaborazione nella comunità SCA. La NDA del troriluzolo riflette rigorose collaborazioni scientifiche tra gruppi di difesa, pazienti e le loro famiglie, esperti clinici in SCA eRifugio biologico. La decisione della FDA di concedere la Priority Review dimostra l’estremamente elevata necessità insoddisfatta in questa rara malattia neurodegenerativa. Il tempo è essenziale per i pazienti con SCA, che soffrono di un declino funzionale inarrestabile e irreversibile, tra cui compromissioni della coordinazione e dell’equilibrio che portano a cadute, perdita della deambulazione e difficoltà di vista, linguaggio e deglutizione.” Dott. Beiner ha aggiunto, “I solidi dati clinici presentati nell’NDA dimostrano un beneficio terapeutico duraturo e convincente nei pazienti con SCA trattati con troriluzolo, una pillola orale da assumere una volta al giorno. Non vediamo l’ora di lavorare a stretto contatto con la FDA durante tutto il processo di revisione per offrire il primo trattamento ai pazienti e alle famiglie che soffrono di SCA.”
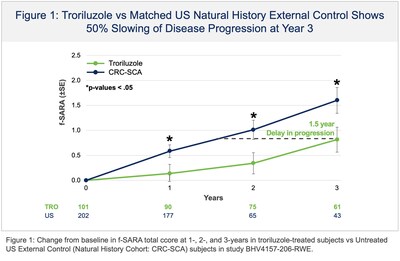
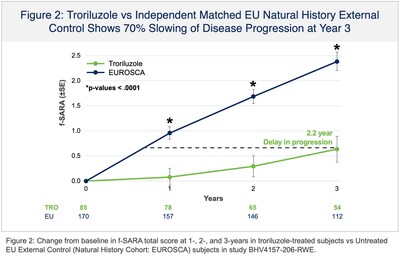
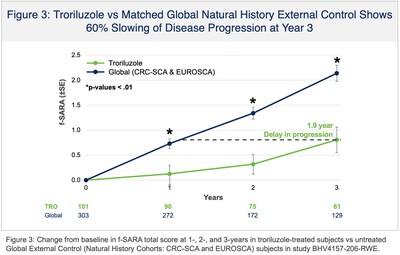
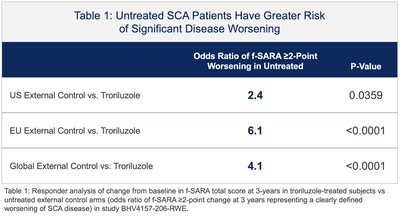
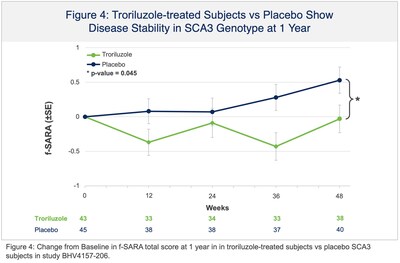
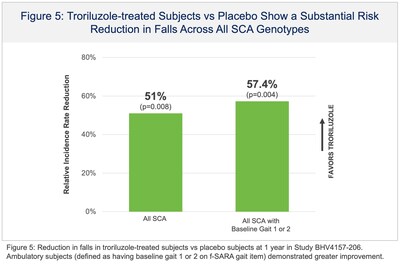
La presentazione NDA si basava, in parte, sui risultati positivi di topline dello studio BHV4157-206-RWE (NCT06529146), in cui il troriluzolo 200 mg somministrato per via orale in pazienti con SCA ha soddisfatto l’endpoint primario dello studio di variazione rispetto al basale sulla scala funzionale per la valutazione e la classificazione dell’atassia (f-SARA), in tutti i genotipi di SCA, a 3 anni rispetto a un braccio di controllo esterno. Il troriluzolo ha mostrato una superiorità statisticamente significativa in 9 endpoint primari e secondari consecutivi prespecificati con effetti del trattamento altamente coerenti, sostenuti, robusti e clinicamente significativi. I pazienti con SCA trattati con troriluzolo hanno mostrato un tasso di declino più lento del 50-70%, che rappresenta un ritardo di 1,5-2,2 anni nella progressione della malattia, nel periodo di studio di 3 anni (Figure 1-3 e Tabella 1). L’NDA include anche dati confermativi e di supporto dagli studi BHV4157-201 e BHV4157-206, i primi grandi studi registrativi multicentrici sulla SCA. In particolare, questi dati includono la stabilizzazione della malattia nel genotipo SCA3 (Figura 4) e una riduzione delle cadute in tutti i genotipi di SCA (Figura 5), entrambi rispetto al placebo per 48 settimane nello studio BHV4157-206.
Jeremy Schmahmann, MD, Professore di Neurologia presso Scuola di medicina di Harvarde direttore fondatore dell’Ataxia Center e della cattedra Martha e Robert Fogelman in atassia e neurologia cerebellare presso Ospedale generale del Massachusetts ha commentato, “L’accettazione da parte della FDA per la revisione di questa NDA rappresenta una pietra miliare fondamentale per i pazienti SCA. Dalla scoperta del primo gene per SCA nel 1993, i pazienti e le famiglie colpite da SCA hanno visto generazione dopo generazione soffrire di disabilità grave e progressiva e morte prematura senza opzioni di trattamento. La necessità di un intervento che possa rallentare la progressione della malattia e aiutare i pazienti a mantenere la propria indipendenza è urgente. Il ritardo nel declino della malattia mostrato nello studio delle prove del mondo reale è uno spartiacque nella storia delle SCA. Questo è ciò che i pazienti stavano aspettando. È ciò che i medici che sono stati impotenti, stavano aspettando. Inoltre, l’importanza degli effetti del troriluzolo sulla riduzione delle cadute in questa popolazione di pazienti non può essere sopravvalutata. Applaudo la FDA per aver riconosciuto questa urgenza concedendo una revisione prioritaria e non vedo l’ora di utilizzare il troriluzolo in clinica se approvato.”
Il programma di sviluppo clinico del troriluzolo in SCA ha raccolto dati per oltre 8 anni, tra cui un solido profilo di sicurezza a lungo termine, ed è stato il primo trial industriale condotto in SCA. Lo studio BHV4157-206-RWE è stato fornito da dati oggettivi di terze parti raccolti da due coorti indipendenti di storia naturale: una in gli Stati Uniti e uno dentro Europa (Studio di storia naturale EUROSCA). La Fondazione Nazionale per l’Atassia(NAF) ha sponsorizzato il Consorzio di ricerca clinica per lo studio di atassia cerebellare (CRC-SCA) che è servito come base per la coorte di storia naturale degli Stati Uniti. I dati del CRC-SCA sono gestiti dall’istituto di informatica sanitaria dell’Università della Florida del Sud. Un totale di 35 siti clinici hanno fornito dati nelle coorti di storia naturale degli Stati Uniti e dell’Europa che hanno svolto il ruolo di controlli esterni in BHV4157-206-RWE. In base alle istruzioni della FDA sul disegno dello studio di prove del mondo reale e sul piano di analisi statistica, il braccio di controllo esterno è stato determinato utilizzando un metodo di Propensity Score Matching (PSM) per garantire che i soggetti non trattati della coorte di storia naturale di confronto fossero rigorosamente abbinati ai soggetti trattati dal braccio troriluzolo dello studio BHV4157-206. Il PSM è stato utilizzato su tutte le caratteristiche prognostiche, demografiche e basali note per essere associate alla progressione della malattia nell’SCA, tra cui f-SARA basale, età, sesso, età all’insorgenza dei sintomi, genotipo e lunghezza della ripetizione del trinucleotide (per genotipo).
Un protocollo di accesso esteso (EAP) sta attualmente arruolando pazienti con SCA che sono idonei. Gli EAP sono progettati per dare un accesso anticipato a potenziali terapie prima che vengano approvate dalla FDA. Ulteriori informazioni sono disponibili su https://clinicaltrials.gov/study/NCT06034886 .
Informazioni sull'atassia spinocerebellare
L’atassia spinocerebellare è un gruppo di disturbi neurodegenerativi ereditari dominanti caratterizzati da progressiva perdita del controllo motorio volontario e atrofia del cervelletto e del tronco encefalico. La SCA colpisce circa 15.000 persone nel Stati Uniti e 24.000 in Europa e il Regno Unito. I pazienti sperimentano una significativa morbilità, tra cui andatura compromessa che porta a cadute, perdita di deambulazione e progressione verso una sedia a rotelle, incapacità di comunicare a causa di problemi di linguaggio, difficoltà a deglutire e morte prematura. Mentre segni e sintomi possono comparire in qualsiasi momento dall’infanzia alla tarda età adulta, l’SCA si presenta in genere nella prima età adulta e progredisce nel corso di diversi anni. Attualmente, non ci sono trattamenti approvati dalla FDA e nessuna cura per l’SCA.
Informazioni su Troriluzole
Il troriluzole è una nuova entità chimica (NCE) e un nuovo profarmaco di terza generazione che modula il glutammato, il neurotrasmettitore eccitatorio più abbondante nel corpo umano. La principale modalità d’azione del troriluzole è la riduzione dei livelli sinaptici di glutammato. Il troriluzole aumenta l’assorbimento del glutammato dalla sinapsi, aumentando l’espressione e la funzione dei trasportatori di aminoacidi eccitatori situati sulle cellule gliali che svolgono un ruolo chiave nell’eliminazione del glutammato dalla sinapsi. L’attività di modulazione del glutammato del troriluzole affronta la deregolamentazione del glutammato ampiamente documentata che è alla base della neurodegenerazione e della disfunzione delle cellule di Purkinje nei pazienti con SCA. Il troriluzole ha anche il potenziale per essere sviluppato in una serie di altre malattie associate a un eccesso di glutammato. Ulteriori informazioni sul troriluzole sono disponibili su Rifugio biologicosito web: https://www.biohaven.com/pipeline/clinical-programs/glutamate/ .
Informazioni su Biohaven
Biohaven è un’azienda biofarmaceutica focalizzata sulla scoperta, lo sviluppo e la commercializzazione di trattamenti che cambiano la vita in aree terapeutiche chiave, tra cui immunologia, neuroscienze e oncologia. L’azienda sta sviluppando il suo innovativo portafoglio di prodotti terapeutici, sfruttando la sua comprovata esperienza nello sviluppo di farmaci e le molteplici piattaforme di sviluppo di farmaci proprietarie. Gli estesi programmi clinici e preclinici di Biohaven includono la modulazione del canale ionico Kv7 per l’epilessia e i disturbi dell’umore; la degradazione delle proteine extracellulari per le malattie immunologiche; l’antagonismo di TRPM3 per l’emicrania e il dolore neuropatico; l’inibizione di TYK2/JAK1 per i disturbi neuroinfiammatori; la modulazione del glutammato per DOC e SCA; l’inibizione della miostatina per le malattie neuromuscolari e metaboliche, tra cui SMA e obesità; molecole bispecifiche di reclutamento di anticorpi e coniugati di farmaci anticorpali per il cancro. Per maggiori informazioni, visita www.biohaven.com.

![]() Visualizza il contenuto originale per scaricare i contenuti multimediali: https://www.prnewswire.com/news-releases/biohaven-annuncia-l-accettazione-da parte-della-fda-e-la-revisione-prioritaria-della-domanda-di-nuovo-farmaco-troriluzole-per-il-trattamento-dell-atassia-spinocerebellare-302373056.html
Visualizza il contenuto originale per scaricare i contenuti multimediali: https://www.prnewswire.com/news-releases/biohaven-annuncia-l-accettazione-da parte-della-fda-e-la-revisione-prioritaria-della-domanda-di-nuovo-farmaco-troriluzole-per-il-trattamento-dell-atassia-spinocerebellare-302373056.html